金属电化学腐蚀倾向的判断
2012-04-01 00:00:00
作者:林玉珍 来源:《腐蚀防护之友》
平衡电极电位与非平衡电极电位
任何一个电极反应,伴随着两类导体相之间电荷的转移同时在两相界面上会发生氧化还原反应。
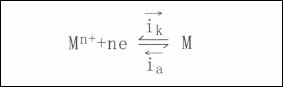
通常,失去电子本身被氧化的反应称之为氧化反应(亦称为阳极反应);夺取电子本身被还原的反应称为还原反应(亦称为阴极反应)。根据法拉第定律,电极反应的速度可用电流密度来表示。式中的 和
和 分别称为该电极反应的阴极和阳极反应的电流密度。
分别称为该电极反应的阴极和阳极反应的电流密度。
平衡电极电位
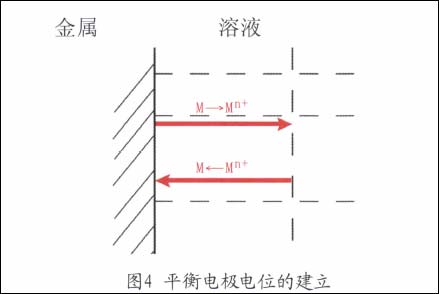
如果在一个电极表面只进行如上所表示的一个电极反应,当这个电极反应处于平衡状态时,其电极电位能达到一个恒定不变的数值,这就是该电极反应的平衡电极电位Ee(如图4所示)。
此时,其阴极反应的速度和阳极反应的速度相等,即:
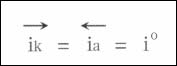
称为该电极反应的交换电流密度,它表明在平衡电位下,正、逆反应的交换速度。任何一个电极反应处于平衡状态时都有它自己的r,它是电极反应一个主要的动力学参数。
平衡电位表明金属与溶液界面已建立起可逆平衡状态,即电荷与物质从金属向溶液迁移的速度和从溶液向金属迁移的速度都相等,即物质和电荷交换都平衡。因此,电极体系不会出现宏观的物质变化,没有净反应发生,也没有净电流出现,即既没有电流从外线路流入电极系统,也没有电流自电极向外线路流出。所以,金属放入含有其本身离子的溶液中,处于平衡状态时,金属是不会腐蚀的。例如,纯Zn放入ZnSO4溶液中和纯铜放入CuSO4溶液中构成的平衡锌电极和平衡铜电极,当它们分别孤立地存在时,它们不发生腐蚀。
如果在标准状态(即参加电极反应物质的活度a=1)时,将各种电极分别与标准氢电极组成一个电池,测得电池的电动势就分别是各电极的标准相对的平衡电极电位Ee0,它是以标准氢电极电位为零的相对值。常把各种可逆电极的标准相对平衡电极电位(简称标准平衡电位),按自上而下从负到正值的次序排列的表称为电动序(相关的资料中均能查到)。平衡电位与金属在溶液中的离子活度关系可用能斯特Nernst公式进行计算,也可用实验方法测得。
非平衡电极电位
如果在一个电极表面进行着两个或两个以上的电极反应时,这种电极系统也能达到一个相对稳定的状态,此时的电极电位称之为非平衡电极电位E(亦称稳定电位)。例如,铁放入稀酸溶液中的情况如图5所示。

此时电极上进行着两个电极反应:

当电极系统稳定时,以上的两个电极反应中,一个是按这一电极过程的阳极反应方向,一个是按另一电极过程的阴极反应方向以相等的速度进行。因此,稳定电位的建立表征反应在电极上都已偏离了各自的平衡状态。此时电极上失去电子是靠某一电极过程,而得到电子则靠另一电极过程。这就表明,电极系统中两相间电荷交换达到了平衡。但是,参加电极反应的物质交换都不平衡。
一个孤立的电极上,同时以相等速度进行着一个电极过程的阳极反应和另一电极过程的阴极反应的现象称为电极反应的耦合,而互相耦合的反应称为共轭反应,相应的电极系统称为共轭体系。体系中,这一对共轭反应都偏离了各自反应的平衡电极电位,同在非平衡电极电位E的数值下进行,电位E是在互相耦合的这两个电极反应的平衡电极电位数值之间,即:
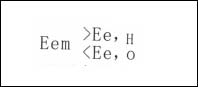
亦称为混合电位。该电极电位不服从Nernst公式,不能计算,只能用实验方法测得。
如果这一对耦合的电极反应中,阳极反应是金属材料的阳极溶解(见图5),其结果导致金属(Fe)的腐蚀破坏。在腐蚀领域中,经常涉及到的是非平衡体系,非平衡电极电位在腐蚀及其控制的研究中有着重要的意义。

2/3 首页 上一页 1 2 3 下一页 尾页
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。