氢去极化腐蚀与氧去极化腐蚀
2012-08-01 00:00:00
作者:林玉珍 来源:《腐蚀防护之友》
(4)阴极过程由氧去极化与氢去极化共同组成。
当i=id时,极化曲线将沿着FSN的走向。电流继续增大,电位向负向移动不可能无限止继续,当电位负到一定程度时,某种新的电极过程也可能进行。例如在水溶液中,当电位负移达氢去极化电位Ee,H后,阴极过程由氧去极化和氢去极化过程共同组成(图中FSQG曲线)此时电极上总阴极电流密度为:
Ik=io+iH
总的阴极极化曲线为Ee,o PFSQG。
氧去极化腐蚀的特点和影响因素
作为去极化剂的氧分子与氢离子有本质的不同,这就使氧去极化腐蚀的特点和影响因素很不相同。
(1)与氧的溶解度有关。
在没有钝化的情况下,溶解氧的浓度越大,反应速度越快,氧的极限扩散电流密度也将越大。因而吸氧腐蚀也随之增大。如碳钢在盐水溶液中的腐蚀。当NaC1的含量达到3.5%左右时,腐蚀速度达到最大。然而,随盐浓度进一步增大,由于氧的溶解度显着降低,所以在浓盐水中碳钢的腐蚀速度反而下降。
(2)浓度极化突出,常常占主要地位。
去极化剂02的溶解度本来就很小,氧分子不带电,向电极表面的输送只能靠对流和扩散,产物没有气体析出,不存在附加搅拌,反应产物也只能靠扩散和对流离开金属表面。因此,氧的阴极反应往往是扩散过程控制。
(3)与金属中阴极性杂质或微阴极的数量或面积的增加关系不大。
在扩散控制下,即使阴极的总面积不大,但可输送氧的溶液体积通道基本已被占用完了,如图6所示。
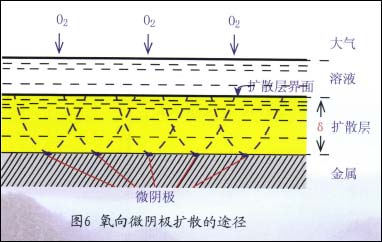
所以,继续增加微阴极并不能引起扩散过程显着增强,也就不会显着增大腐蚀速度。
(4)溶液流速的影响。氧浓度一定时,极限扩散电流密度与扩散层厚度δ成反比。溶液流速越大,扩散层厚度越小,氧的极限电流密度就越大,腐蚀加剧。若在很高的流速作用下,金属或合金会发生“湍流腐蚀”和“空泡腐蚀”,使材料和设备破坏更大。
对于有钝化倾向的金属,当未进入钝态时,适当增大流速,增强氧的扩散,可能导致金属进入钝态而降低腐蚀。一旦流速更高,也可能破坏钝态,使腐蚀重新加剧。因此,对这类金属流速影响复杂,应具体问题具体分析。
(5)温度的影响。
溶液温度升高,将使氧的扩散过程和反应速度加快,使腐蚀速度增大。另外,随温度升高,氧的溶解度降低,腐蚀速度随之减弱。因此在敞口系统中,二种相反因素作用,使腐蚀有一个最大值。如图7所示。
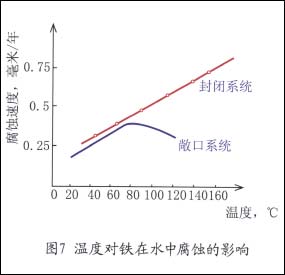
在封闭系统中,随温度升高使气相中氧的分压增大,从而增加氧的溶解度,因此,腐蚀速度将一直随温度的升高而增大。
实践证明,在大多数的情况下,电化学腐蚀都与阴极过程的特征有关。特别是氧去极化的阴极阻滞对腐蚀过程有显着的影响。
另外,值得注意的是:放置在空气中的酸溶液,都会溶解有一定的氧,在酸溶液中氧的还原电位(Ee,o=0V)要比氢离子的还原电位(Ee,H=1.229V)正得多,氧比氢离子的还原更容易。可氧在稀酸溶液中的溶解度很小(8~8.5×10ˉ4mO1/L)。因此,酸中溶解氧引起的腐蚀对金属总腐蚀的速度影响就很小,可以忽略。但是,当酸溶液中有强烈搅动的情况下或有抑制H+还原的高效缓蚀剂时,溶解氧的作用就不能忽视。
5/5 首页 上一页 3 4 5
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。