金属腐蚀的机理与评级标准
2019-10-10 16:26:07
作者:本网整理 来源:机械小众
金属腐蚀是由金属在离子化倾向的水溶液中成为离子的难易度决定的。金属的离子化倾向以标准电极电位表示。标准电极电位是以氢离子(H)为基准,离子化倾向强的金属易于溶解,即易于腐蚀,其标准电极电位取负值,称为“普通金属”。而离子化倾向低的金属难于溶解,即耐腐蚀,其标准电极电位取为正值,称为“耐腐蚀金属”。金属电离成为离子,在其表面就会进行电化学反应。
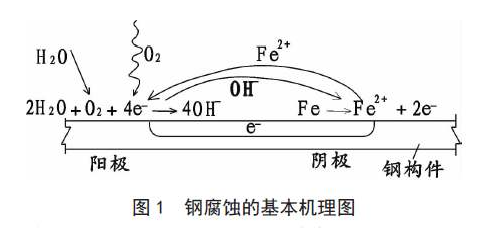
以铁为例,铁与附着在其表面上的水(H2O)和氧(O2)进行反应,则生成氢氧化铁[Fe(OH)2],进一步反应成为Fe(OH)3,这就是显而易见的红色铁锈。
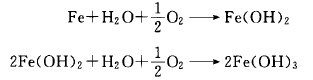
铁(Fe)从金属原子结晶晶格中脱离而成为铁离子(Fe+)。在溶液中进行移动反应(阳极氧化反应),同时在溶液中溶解的氧接受了游离的电子(e-)成为氢氧化物的离子(阴极还原反应),反应用下式表示:
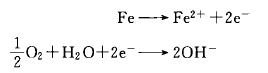
酸性溶液中,氢离子(H+)因为浓度高(pH值低),接受游离的电子(e-),反应生成氢(H2)。
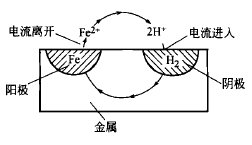
这种阳极反应和阴极反应相组合进行的腐蚀机理,如图所示。
金属腐蚀的评级标准:
金属的耐腐蚀性能与金属的其他性能一样,表明金属材料的耐腐蚀性时,必须明确地说明其外界条件,如化学介质的成分、温度、流速等,然后用腐蚀速度的高低来区别耐腐蚀性能的高低。腐蚀速度用单位时间内单位面积金属材料的损失量来表示;也可用单位时间内金属材料的腐蚀深度来表示。表1-1列出了工业上常用的六类10级的耐腐蚀性评级标准;表1-2列出了一些金属材料的耐腐蚀性。
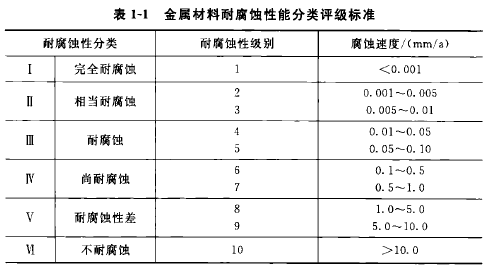
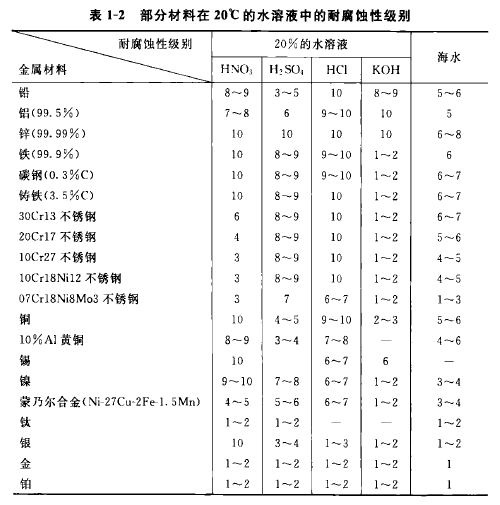
如果在使用过程中要求保持镜面或尺寸精密的设备,应选用1~3级的不锈钢;要求长期不漏或要求使用年限的设备,应选用2~5级;对于检修方便或寿命无需很长的设备,可选用4~7级的不锈钢。对于年腐蚀率超过1mm的一般不选用。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。