海洋资源的开发利用需要大量海上设施设备,如用于海洋石油开采的钻井平台,海洋风力发电设备及跨海大桥等。目前,作为海上设备平台使用的工程结构材料多为金属材料,在恶劣的高腐蚀海洋环境中极易发生腐蚀。目前,在全浸泡环境中金属材料的防腐蚀措施通常采用重防腐涂料联合阴极保护作为主要的腐蚀防护手段。
然而,阴极保护会产生过剩的OH-使得涂层与金属界面发生碱化,从而导致涂层阴极剥离。关于阴极剥离已有许多学者进行了研究。Bi等研究了低碳钢表面涂层下阴极氧还原与阴极剥离的关系,认为氧的还原反应产生的界面碱化导致了涂层的剥离。Shi等使用局部扫描振动电极技术 (SVET) 研究了低碳钢上缺陷环氧涂层防护作用,结果表明:施加阴极保护,涂层缺陷处形成的钙质膜层有利于阴极保护过程。Eltai等认为阴极保护导致完好环氧清漆涂层的阻抗下降,涂层的吸水量由于阴极保护电位的提高而增加。李玉楠研究了阴极保护对破损有机涂层防护作用的影响,结果表明:完好涂层的-850 mV (vs Cu/CuSO4) 保护准则对破损涂层是不适用的,为了阴极保护能够发挥正常的作用,应该将保护电位负移。张丽研究了外加电流阴极极化下环氧清漆及环氧富锌涂层的失效行为,结果表明:对环氧清漆涂层施加-900 mV (vs SCE) 阴极保护后,增强了基材/涂层界面处的碱性环境,加速了涂层中交联结构破坏,减弱了基材/涂层界面处的附着力,降低了涂层寿命。
本文主要研究不同阴极保护电位对破损环氧涂层下海洋平台研制钢的阴极保护效果及对破损的高附着化学键合防腐涂料防腐性能的影响及阴极剥离机理。
1 实验方法
实验中所用的金属基体材料为海洋平台研制钢,其化学成分 (质量分数,%) 为:C 2.76,Mo 0.58,Si 0.24,Ni 2.61,Cr 0.79,Fe 92.48。钢片的尺寸为50 mm×50 mm×3 mm,参照GB 13288-1991《涂装前钢材表面粗糙度等级的评定》中关于涂装前钢材的表面粗糙度等级相关规定,将试样进行喷砂处理,再经丙酮超声除油,无水乙醇除水,吹干,置于干燥器中备用。
本实验所用的涂料是由哈尔滨工程大学研制的HGL-2化学键合防腐涂料底漆,使用前按A、B组分质量比3∶1混合搅匀,抽真空除去涂料中气泡,静置1 h后,均匀涂覆到备用钢片上。25 ℃固化24 h后,60 ℃固化48 h。
采用Ф=3 mm的钻孔器人为制造涂层缺陷,缺陷面积约占测试面积的0.6%。
采用PosiTector6000测厚仪测定涂层厚度,选取固化后涂层厚度为 (100±5) μm的试样进行电化学阻抗谱 (EIS) 测试。
本实验施加阴极保护的恒电位仪为IviumStat电化学工作站,参比电极为饱和甘汞电极,辅助阳极为自制的高纯度石墨电极,有效实验面积为11.34 cm2,破损面积约占测试面积的0.6%。实验在室温静态模拟海水中进行,实验装置示意图如图1所示。本实验采用人工海水溶液,溶液配方参照国标GB/T 7790-2008,NaCl:23 g/L,MgCl2·10H2O:9.8 g/L,Na2SO4·10H2O:8.9 g/L,CaCl2:1.2 g/L。
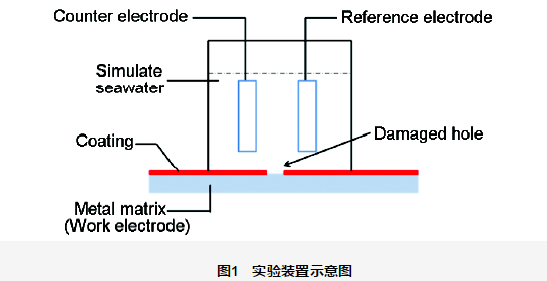
对于海洋工程而言,金属材料所要求的阴极保护电位比稳态下自腐蚀电位至少低200 mV;对于涂覆有机涂层的保护体系,目前最常使用的电位规范是-850 mV (vs Cu/CuSO4),即-780 mV (vs SCE)。潘大伟等研究了-750~-950 mV (vs Ag/AgCl) 电位对于海洋高强钢 裸钢)的保护效果,结果表明最佳的阴极保护电位区间为-0.76~-0.94 V。众所周知有机涂层本身具有防护效果,可以降低阴极保护电位;而-780 mV (vs SCE) 是完整涂层常用的保护电位,不是其最低的保护电位。本实验所用的试样是0.6%破损的有机涂层金属体系,所以为了方便电位节点的设置 (本实验以100 mV为梯度来设置保护电位) 以及参考海洋工程中有机涂层选择的阴极保护电位,故而本文选择了-750,-850,-950和-1050 mV (vs SCE) 对海洋平台研制钢在模拟海水中进行HGL-2化学键合防腐涂料与阴极保护联合保护效果的研究。
施加了不同阴极保护电位的涂层耐腐蚀性能测试采用PGSTAT302电化学工作站进行EIS测试。测试选用三电极体系:施加阴极保护电位的试样为工作电极,Pt片为辅助电极,饱和甘汞电极为参比电极 (SCE)。阻抗测试频率范围为105~10-2 Hz,扰动信号为10 mV,试样测试面积为11.34 cm2,破损面积约占测试面积的0.6%。测试溶液为人工海水溶液。为了防止外界电磁信号的干扰,EIS测试在Faraday屏蔽笼里进行。测试得到的EIS数据均采用ZSimpWin软件进行拟合。
采用JSM-6480型扫描电子显微镜 (SEM) 对涂层下的金属基体进行表面微观形貌观察,采用SAM型X射线能谱仪 (EDS) 对金属基体元素进行分析,并采用X'PertPro型X射线衍射仪 (XRD) 对金属表面附着产物进行物相分析。根据国标GBT 16545-2015 金属和合金的腐蚀 -腐蚀试样上腐蚀产物的清除,采用浸泡法去除金属表面的附着物。
2 结果与讨论
2.1 宏观腐蚀形貌
破损涂层施加不同阴极保护电位1056 h后,试样的宏观表面形貌如图2所示。在开路电位 (未施加阴极保护) 下的试样 (图2a) 破损处发生了严重的腐蚀,涂层表面附着了大量的腐蚀产物,破损涂层周围未见明显鼓泡现象。施加阴极保护电位的试样(图2b~e),破损处的金属腐蚀程度降低,表面无明显锈蚀产生;但随着阴极保护电位的增加,破损处白色沉积物增多,破损周围的涂层发生鼓泡的程度增大。施加不同阴极保护电位1056 h后涂层鼓泡情况见表1。每个电位下均观察4个平行试样,鼓泡数目及鼓泡处距离破损边缘的距离均为4个平行试样的平均值。可见,施加不同阴极保护电位1056 h后,随着电位的负移,涂层鼓泡数量增多,鼓泡处距离破损边缘的距离变大。
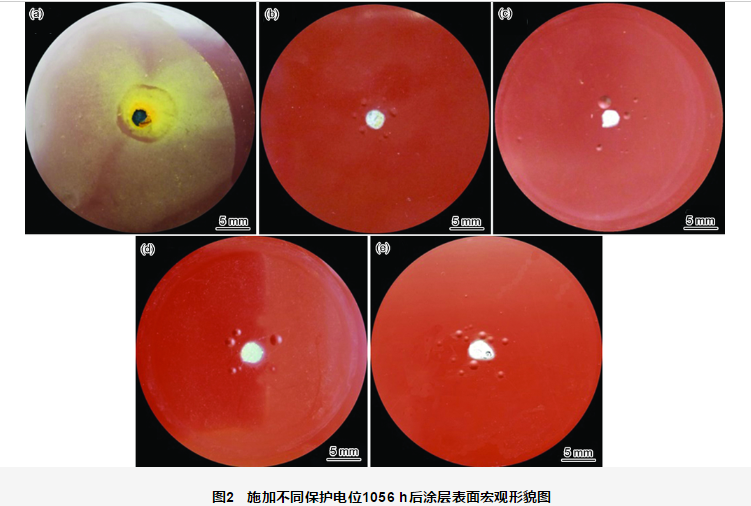
图3为施加不同阴极保护电位后涂层阴极剥离形貌。每个电位下均观察4个平行试样,阴极剥离距离及剥离面积均为4个平行试样的平均值。施加不同保护电位1056 h后涂层的剥离距离及剥离面积见表2。图4为图3c腐蚀处的局部放大图,A处于未腐蚀区域,B处于图中黑色腐蚀区域,A和B处的EDS分析结果见表3。

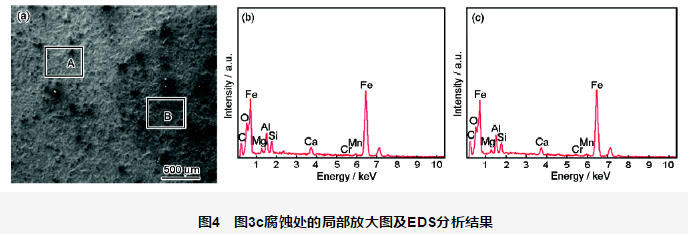
由图3及表2可知,开路电位下的涂层阴极剥离面积最小,仅54 mm2,但破损处有明显腐蚀发生。在-750 mV保护电位下,剥离面积增大 (增至117 mm2),破损处仍有腐蚀发生,说明此时处于欠保护状态。-850 mV保护电位下,剥离面积进一步增大 (增至169 mm2),破损处未发生腐蚀,说明对破损处金属基体保护效果较好。但在涂层鼓泡处,基体颜色较深,EDS结果 (图4及表3) 显示鼓泡区域O含量 (原子分数) 要略高于未鼓泡区域的,而Fe含量要略少于未鼓泡区域的,说明鼓泡处仍有一定腐蚀,但腐蚀非常弱。这是由于涂层的电流屏蔽作用,尤其是在涂层鼓泡失效后,涂层下的金属可能未达到完全停止腐蚀所需的保护电流。对于-950 mV保护电位而言,阴极剥离程度与-850 mV保护电位下的相比略有增加 (增至183 mm2),但破损处与剥离处均未发生腐蚀,保护效果良好。-1050 mV保护电位下,破损处发生了严重的析氢现象,基体虽未发生腐蚀,但涂层剥离面积剧增 (增至243 mm2)。
2.2 EIS测试
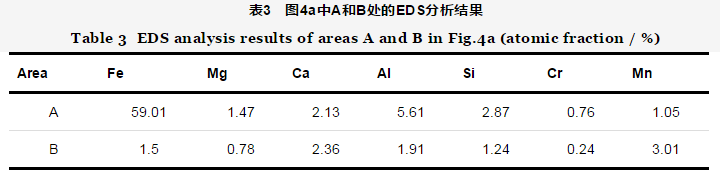
EIS技术常被用于腐蚀过程的研究。本实验对不同保护电位下的试样进行EIS测试,其测试结果采用图5中的等效电路图进行拟合。由于破损区域较大,电化学阻抗主要反映破损处及涂层剥离区域的信息。其中,Rs是电解质溶液电阻;Qc是常相位角元件,代表沉淀膜电容;Rf是沉淀膜层电阻;Qdl代表双电层电容;Rt代表电荷转移电阻。
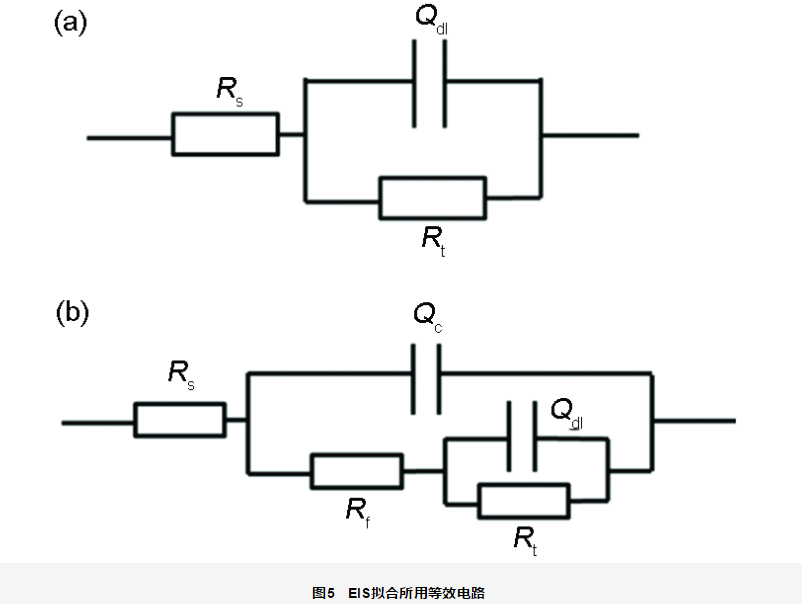
图6a为开路电位下试样的EIS测试结果。结果显示,随着浸泡时间的延长,容抗弧半径减小,测试体系的低频阻抗模值不断地下降,说明随着浸泡时间的延长,试样腐蚀程度不断加剧。在浸泡开始阶段 (100 h),由于涂层破损处无保护作用,采用一个时间常数进行拟合 (图5a) ;随着浸泡时间的延长,腐蚀产物不断堆积,在破损处的表面形成了腐蚀产物膜,浸泡后期采用两个时间常数进行拟合 (图5b)。
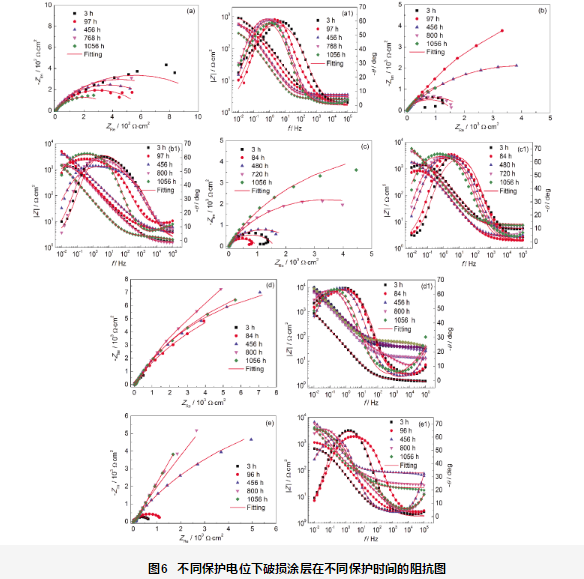
图6b是在-750 mV保护电位下的EIS测试结果。在浸泡97 h内,涂层容抗弧稍有增大,这可能是破损处产生了稀疏的沉积层导致阻抗略增大;之后,破损处发生了腐蚀,阻抗下降,说明在模拟海水中,-750 mV保护电位不能完全为基体提供保护。在实验初期 (100 h),采用一个时间常数 (图5a) 进行拟合,随着时间的延长,破损处表面生成稀疏的沉积层,采用两个时间常数 (图5b) 进行拟合。
图6c是-850 mV保护电位下的EIS图。随着时间的延长,涂层的容抗弧增大,阻抗值呈现上升趋势,腐蚀倾向较小,说明破损处金属处于保护状态。在实验过程中,破损处逐渐形成了一层白色沉积层,导致体系中阻抗上升。说明这层沉积层对破损处的金属有一定的保护作用,采用两个时间常数 (图5b) 进行拟合 (100 h之后)。
图6d是在-950 mV保护电位下的EIS图,与图6c相似,随着时间的延长,涂层的阻抗值呈现上升趋势,说明破损处金属处于保护状态,腐蚀倾向较小。破损处形成了沉淀层,采用两个时间常数的等效电路图 (图5b) 进行拟合 (100 h之后)。
图6e是在-1050 mV保护电位下的EIS图。在施加1056 h阴极保护期间,体系的阻抗值先升高后稍有降低,50 h后谱图体现出两个时间常数的信息,采用图5b进行拟合,并且在实验过程中破损处可观察到十分严重的析氢现象。
2.3 不同保护电位对钙质沉积层保护性能的影响分析
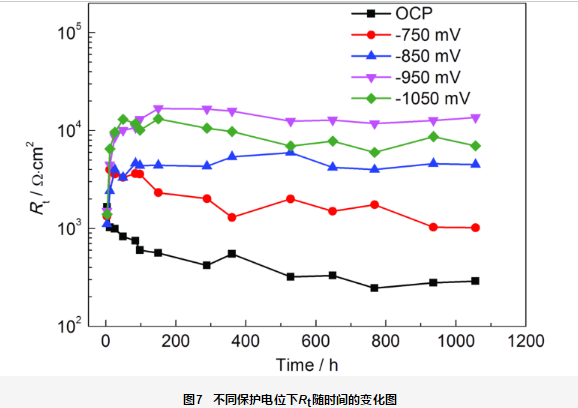
Rt表征金属腐蚀发生的难易程度,Rt越高,金属越不容易发生腐蚀。图7为不同保护电位下的EIS数据拟合的Rt随时间的变化曲线。由等效电路图可知,在实验过程中,EIS主要反映破损处金属基体的信息。在开路电位下,Rt从开始的103 Ω·cm2下降到400 Ω·cm2,之后稳定在约200 Ω·cm2,表明金属基体随着浸泡时间的延长,更容易发生腐蚀。-750 mV保护电位下,实验初期Rt稍有上升,100 h后略有下降,之后稳定在约3×103 Ω·cm2;-850 mV保护电位下,Rt逐渐上升,100 h后稳定在约4×103 Ω·cm2。-950 mV保护电位下,Rt逐渐上升,180 h后达到约2×104 Ω·cm2,之后稳定在1.2×104 Ω·cm2,具有最好的耐蚀性能。-1050 mV保护电位下,Rt逐渐上升,84 h后达到最高值约1.2×104 Ω·cm2;之后稍有降低,耐蚀性能略有下降。
Rf一定程度上反映了钙质沉积层保护性能的好坏,Rf值越高,钙质沉积层保护性能越好。图8为施加保护电位1056 h期间不同保护电位下的Rf随时间的变化曲线。由图可知,在开路电位及-750 mV保护电位下,Rf均很小,在10~100 Ω·cm2之间变化,沉积层几乎无保护作用。-850 mV保护电位下,破损处Rf较开路电位和-750 mV保护电位下的略大,约在100 Ω·cm2变化。-950 mV保护电位下的Rf值一直呈现增大趋势,在350 h后稳定在约2000 Ω·cm2。施加-1050 mV保护电位前期 (150 h),Rf值上升,之后略有下降,稳定在约800 Ω·cm2。结果显示,-950 mV保护电位下,钙质沉积层的保护性能最佳。
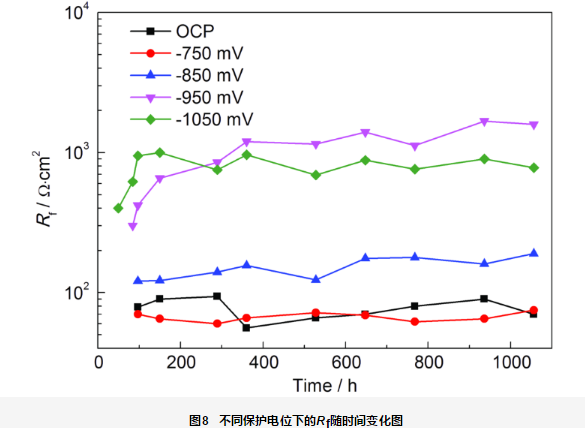
图9为施加不同保护电位破损处沉积层物相分析结果。可见,在开路电位下破损处的腐蚀产物膜层成分为Fe2O3;-750 mV保护电位下,沉淀膜成分为CaCO3和Fe2O3,无Mg(OH)2;-850,-950和-1050 mV保护电位下沉积层的成分均为CaCO3和Mg(OH)2的混合物,无Fe2O3。李成杰等[17]研究了在静态及动态条件下钙质沉积层中Ca/Mg比值的变化,结果表明在-800~-1000 mV (vs SCE) 电位下均能形成不同Ca/Mg比值的钙质沉积层。
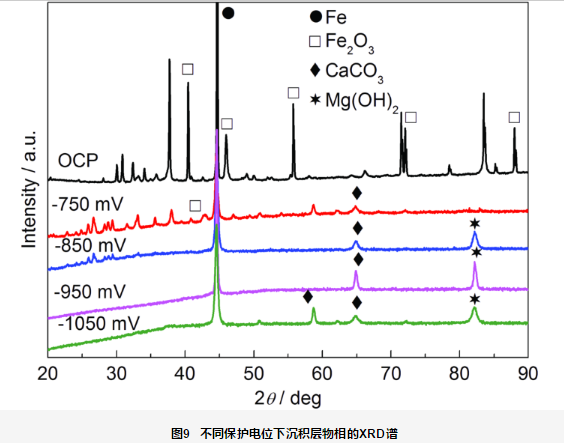
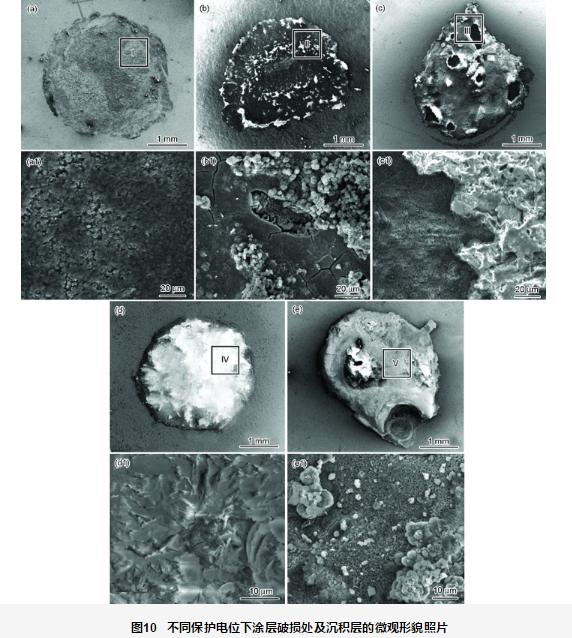
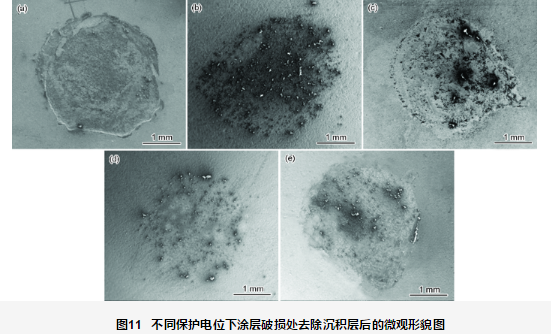
图10为施加不同保护电位下浸泡1056 h后破损处的表面微观形貌图,图11为相应地去除沉积层后的微观形貌图。开路电位下破损处的金属基体经1056 h浸泡,表面生成大量的腐蚀产物 (图10a),去除腐蚀产物后可见明显的腐蚀坑 (图11a)。在此过程中,涂层阻抗值不断下降,电荷转移电阻最低,但涂层的剥离程度较小。当不施加保护电位时,随着水溶液沿着涂层破损处渗透到涂层/金属界面区,溶解氧也随水溶液一起扩散到界面区,导致作为阳极的金属基材发生腐蚀溶解反应,阴极发生溶解氧的还原,发生如下反应:
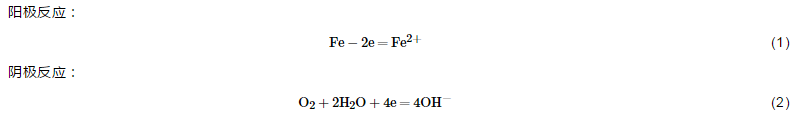
Fe的溶解量与OH-的生产量成正相关,受到腐蚀的金属少,产生的OH-少,引起界面的碱化程度低,故而涂层未鼓泡,剥离面积小。
从图10b可看出,-750 mV保护电位下,破损处有腐蚀产物,同时有稀疏的CaCO3沉积产生,无Mg(OH)2,沉淀层不完整,这是由于在静态条件下CaCO3容易成核,而Mg(OH)2的形成需要在pH值达到9.3以上才能成核[17,18]。而在-750 mV电位下的界面碱性较弱,不能形成Mg(OH)2沉淀。去除表面的沉积层及腐蚀产物后,金属没有形成腐蚀坑。施加阴极保护电位时,仍主要发生式 (2) 的阴极反应。由外加阴极极化提供电子。当外电流提供的电子不能完全满足氧的去极化反应时,金属则会发生腐蚀以提供电子,即发生反应式 (1)。结合图3b可看出,施加-750 mV保护电位时保护不足,此时的腐蚀速率小于自然浸泡下的金属腐蚀速率,但阴极保护造成的界面碱化程度较高,造成涂层的剥离面积远远大于不施加阴极电位涂层的剥离面积。
从图10c可看出,-850 mV保护电位下钙质沉积层较-750 mV的多,沉积层分布不均匀,与基体表面相接触的沉积层成分主要为Mg(OH)2,比较疏松,呈絮状物沉积在表面,有的区域表面沉积层相对较厚,颗粒较大,其主要成分为CaCO3。这可能是因为在阴极极化条件下,带正电的Mg(OH)2会被吸附到带负电的金属表面,而呈现颗粒状的CaCO3的生长是在Mg(OH)2生长之后[17,19]。整个区域的沉淀层生长不均匀,膜层不完整,因此沉淀膜电阻较低。去除钙质沉积层之后,金属基体表面未见明显腐蚀坑。
从图10d可看出,-950 mV保护电位下整个钙质沉积层则较为均匀完整,无明显孔洞,钙质沉积层较为致密,膜层质量较好,钙质沉积层成分主要为CaCO3和Mg(OH)2。结合图8可知,此时有较高的膜层电阻,约在103 Ω·cm2波动。去除沉淀膜层之后,金属基体未见腐蚀坑。说明-950 mV保护电位对破损处金属体系具有较好的保护效果。
在外加-850或-950 mV保护电位时,涂层剥离面积增大,仍主要发生式 (2) 的阴极反应。由于阴极极化增大,离子及氧的迁移加快,氧被还原成OH-的速度加快,局部pH值上升,碱性环境增强,使得涂层剥离加大。
从图10e可看出,-1050 mV保护电位条件下的钙质沉积层较厚,为CaCO3和Mg(OH)2的混合钙质层,钙质沉积层表面随机分布着絮状的Mg(OH)2及颗粒状的CaCO3,沉积层存在明显孔洞。去除沉淀膜层后,破损处的金属基体未见明显腐蚀痕迹。-1050 mV保护电位时,阴极除了发生式 (2) 的反应外还发生式 (3) 的反应:

H2的产生破坏了沉积层的完整性,表现为多孔的膜层和相对较低的膜层电阻,虽然金属基体未发生腐蚀,但严重的析氢导致OH-的增多,生成大量的OH-加剧了涂层的阴极剥离 (图3)。
综上结果,-850,-950和-1050 mV保护电位对金属基体的保护效果较好,开路电位及-750 mV保护电位下的保护性较弱。-1050 mV保护电位下,阴极主要发生式 (2) 和 (3) 两个界面反应,界面碱性较强,严重破坏了涂层与金属界面的附着力;从图3及表4可以看出,涂层剥离面积大 (243 mm2)。而在-850和-950 mV电位下,主要发生式 (2) 的反应,界面碱化程度相对较低,阴极剥离程度相对较小,涂层剥离面积分别为169和183 mm2,在此保护电位范围内,破损处的基体均未发生腐蚀。但对于涂层鼓泡处,由于涂层的电流屏蔽作用,-850 mV (vs SCE) 不能完全抑制涂层鼓泡处的金属发生腐蚀,但腐蚀非常微弱。-950 mV保护电位下的沉淀膜层较为完整致密,阻抗及沉淀膜层电阻均较高。故而综合考虑阴极保护电位的保护效果、界面碱化程度、阴极剥离程度等结果,认为在本实验所研究的电位范围内涂层防护与阴极保护协同作用最佳的保护电位是-950 mV。
3 结论
(1) 在本实验选择的保护电位中,随着电位的负移,涂层剥离面积逐渐增大。
(2) 不同保护电位下破损处都生成了CaCO3或者CaCO3和Mg(OH)2的混合钙质沉积层。其中,-950 mV (vs SCE) 保护电位下生成的沉积层完整致密。
(3) 保护电位-750 mV不能完全为金属基体提供保护;在此保护电位下,破损处金属仍会发生腐蚀。-850和-950 mV保护电位均能对破损处金属提供良好的保护,使金属基体不发生腐蚀。但由于涂层的电流屏蔽作用,-850 mV不能完全抑制涂层鼓泡处的金属腐蚀,但腐蚀程度很轻;-1050 mV保护电位下金属基体未发生腐蚀,但破损处发生了严重的析氢现象,界面碱化程度较大,涂层剥离程度最大。