王毅,张盾
山东省腐蚀科学重点实验室,中国科学院海洋研究所,青岛,中国,266071
Email:zhangdun@qdio.ac.cn
第一作者简介
王毅(Wang Yi),男,1981年9月生,工学博士,中国科学院海洋研究所助理研究员,现从事海洋腐蚀与防护研究。2004年毕业于北京化工大学应用化学专业,获应用化学理学学士学位。2009年在北京化工大学获应用化学工学博士学位,之后至今在中国科学院海洋研究所海洋腐蚀与防护研究发展中心从事海洋腐蚀与防护的研究。作为课题负责人承担国家自然科学基金青年科学基金项目和山东省自然科学基金青年项目各一项。作为研究骨干参加了863项目、中国科学院知识创新工程重要方向性项目和国家海洋局公益性项目的研究工作。攻读博士学位期间被评为北京化工大学研究生“十大学术之星”,曾荣获“原平化工”及“烟台万华”专项奖学金,并获得化工资源有效利用国家重点实验室优秀博士生、北京化工大学优秀研究生及北京化工大学优秀毕业生等荣誉称号,同时博士论文被评为2010年北京市优秀博士论文。在无机功能材料组装化学和电化学领域取得了一定研究成果,共发表各类研究论文30余篇,被SCI期刊收录论文20篇(第一作者10篇),总影响因子加合大于60,单篇最高引用20次,申请国家发明专利11项,已授权4项,公开4项,申请国际专利2项,均已公开。

王毅
摘 要:通过动电位极化和电化学交流阻抗谱等电化学方法研究了海藻酸钠(Sodium Alginate,SA)作为一种绿色缓蚀剂在3.5% NaCl溶液中对Q235钢的缓蚀作用。结果表明SA对碳钢在3.5% NaCl溶液中的缓蚀作用主要为阳极抑制型,298 K时SA在浓度为0.5 gL-1时缓蚀效率达到最高为94.7%。对热力学参数进行了讨论,表明SA在Q235钢表面上的吸附行为服从Langmuir吸附等温式,SA的吸附为自发的放热过程,为典型的化学吸附。
关键词:Q235钢;缓蚀剂;海藻酸钠;模拟海水;吸附
1 引言
在众多防腐蚀方法中,添加缓蚀剂是一种工艺简便、成本低廉、适应性强的缓蚀措施。但是,随着人们环保意识的增强,以及日益严格的环保法规的限制,一些有毒的缓蚀剂将被限制或禁止使用[1]。因此,开发天然、低毒或无毒、环境友好型缓蚀剂已迫在眉睫[2]。近年来,人们开发了多种环境友好型缓蚀剂,范围从无机化合物稀土元素[3-6]到有机化合物,如丁二酸[7]、氨基酸[8-10]、抗真菌药物[11]、咖啡酸[12]、色胺[2]、巴比妥品[13, 14]和天然产物[15-17]。
海藻酸钠(Sodium Alginate,SA)是一种提取自褐藻细胞壁的天然产物。在食品工业和日用化学品工业中被用作乳化剂或增稠剂。在制药业中,海藻酸是常用的辅料。牙科用它来替代石膏及橡胶,制作牙模。SA是由α-L-甘露糖醛酸(M单元)与β-D-古罗糖醛酸(G单元)依靠1,4-糖苷键,连接并由不同GGGMMM片段组成的共聚物-甘露糖醛酸单元含有大量羧基,可与金属配位。因此,海藻酸钠是一类潜在的绿色缓蚀剂。但是,目前还未见相关报道。#p#分页标题#e#
本工作采用动电位极化曲线和电化学交流阻抗(EIS)技术,对SA在模拟海水(3.5% NaCl溶液)中对Q235钢的缓蚀性能进行了深入研究,并采用吸附等温线研究了其缓蚀机理。
资助信息:山东省自然科学基金(ZR2010BQ017);中国科学院海洋研究所知识创新前沿项目(Y02607101Q)。
2 实验部分
2.1 实验试剂
分析纯NaCl购自国药集团。化学纯SA(平均分子量50000)购自天津博迪化学试剂公司,其结构式见图1[18]。实验用水为Milli-Q水(Millipore, USA)。
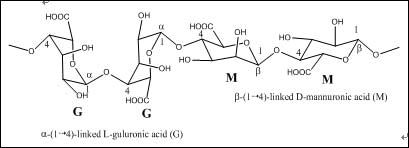
图1. SA结构示意图
2.2 电化学测试
实验在三电极玻璃电解池中进行。工作电极为Q235钢电极,其化学组成见表1,采用Araldite®环氧树脂封装,电极暴露面积0.196 cm2;辅助电极为铂丝电极;参比电极是银/氯化银(Ag/AgCl, 3 M KCl)电极。工作电极在实验前依次用400、600、800、1000号砂纸打磨,超声清洗10 min,室温干燥备用。电解质为3.5% NaCl溶液。电化学试验,包括动电位极化曲线和EIS均在CHI760C电化学工作站(上海辰华)上进行。电化学实验前将碳钢电极浸泡在测试溶液中30 min直至开路电位(Eoc)稳定。所有测试均在室温下进行。动电位极化曲线测试电位为-300到300 mV(vs. Eoc),扫描速度0.5 mV s−1。在极化方法中,公式1用于计算缓蚀效率(hp),其中i'corr和icorr分别是有和没有缓蚀剂存在下的电流密度。
 (1)
(1)
表1. Q235钢化学组成
| C | Mn | Si | S | P | Fe |
| 0.10 | 0.40 | 0.12 | 0.02 | 0.05 | 99.31 |
在开路电位下进行EIS测试,频率范围105 Hz到10−1 Hz,振幅5 mV。采用ZSimpWin 3.10软件分析EIS数据。缓蚀效率(hE)可以用下式计算:
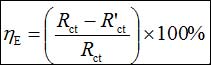 (2)
(2)
其中Rct 和R'ct分别是有和没有缓蚀剂下的电荷转移电阻。
3 结果与讨论
3.1 动电位极化曲线分析
图2给出Q235钢电极在加有和不加有SA的3.5% NaCl溶液中的极化曲线,相应的电化学参数,包括腐蚀电位(Ecorr)和icorr列于表2。根据公式1计算的hp也列于表2。由表可见,随着SA浓度的增大,icorr减小,Ecorr正移,在SA浓度为0.5 g L-1时,hp达到最大值94.3%。此外,进一步增大SA浓度,hp值将减小。这是由于SA为高分子化合物,增大浓度将会增大粘度,粘度的增大会影响其吸附性能,从而降低缓蚀效率。同时从表2中可以看到加入SA后Ecorr移动较大,根据Riggs Jr的研究结果[19],如果电位移动值大于85 mV,缓蚀剂将被认为是阳极型或阴极型缓蚀剂。在此研究中,腐蚀电位向正方向移动最大变化值达到136 mV,说明该缓蚀剂为阳极型缓蚀剂。SA在碳钢电极表面吸附形成吸附膜,阻止腐蚀离子向金属表面迁移,抑制阳极溶解,从而抑制腐蚀。

图2. Q235钢在含有不同浓度SA的3.5% NaCl溶液中的极化曲线
从图2中SA浓度为0.5 g L−1时的阳极极化曲线可以看到当电极电位高于?250 mV时,阳极腐蚀电流随电位增大迅速增大,这是由于金属溶解导致SA吸附速率小于解吸速率[20]。
表2. 由图2极化曲线得到的电化学参数
| Concentration (g L-1) |
-Ecorr (mV) |
icorr (μA cm-2) |
hp (%) |
| 0(blank) | 691 | 68.7 | - |
| 0.06 | 617 | 9.4 | 84.8 |
| 0.12 | 570 | 6.8 | 88.7 |
| 0.25 | 593 | 6.0 | 89.9 |
| 0.50 | 555 | 2.9 | 94.3 |
| 1.00 | 572 | 4.6 | 91.8 |
3.2 EIS分析
图3给出了Q235钢电极在加有和不加有SA的3.5% NaCl溶液中的Nyquist谱图。这些曲线都表现为一压缩半圆,这是由于电极表面粗糙度高和电流的几何效用导致的的[21]。因此,在等效电路中,常相角元件(CPE)被用于替代纯电容元件[22]。采用图4所示等效电路对EIS数据进行合[23],拟合结果见表3。在这个模型中,Rs为溶液电阻,Rf为膜电阻,Rct为电荷转移电阻。拟合数据和实验数据有很好的拟合度。#p#分页标题#e#
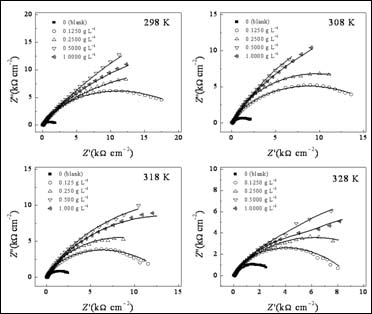
图3. 不同温度Q235钢电极在含有不同浓度SA的3.5% NaCl溶液中Nyquist谱图(实线代表拟合曲线)
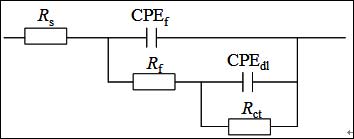
图4. EIS拟合电路示意图
表3. 由图3EIS数据拟合得到的电化学参数
| T (K) |
C (g L-1) |
Qdl (μF cm-2) |
Rct (Ω cm2) |
hE (%) |
| 298 | 0.000 | 2660 | 149.4 | |
| 0.125 | 908 | 926.7 | 83.9 | |
| 0.250 | 894 | 1107.0 | 86.5 | |
| 0.500 | 868 | 2612.7 | 94.7 | |
| 1.000 | 879 | 1991.4 | 92.5 | |
| 308 | 0.000 | 5561 | 138.0 | |
| 0.125 | 1716 | 712.3 | 80.6 | |
| 0.250 | 1600 | 743.2 | 81.4 | |
| 0.500 | 1432 | 2148.2 | 93.6 | |
| 1.000 | 1610 | 1422.8 | 90.3 | |
| 318 | 0.000 | 5938 | 112.1 | |
| 0.125 | 1576 | 527.2 | 78.7 | |
| 0.250 | 1458 | 564.5 | 80.1 | |
| 0.500 | 1127 | 1393.0 | 92.0 | |
| 1.000 | 1333 | 1063.1 | 89.5 | |
| 328 | 0.000 | 5693 | 91.3 | |
| 0.125 | 1833 | 346.7 | 73.7 | |
| 0.250 | 1680 | 427.1 | 78.6 | |
| 0.500 | 1280 | 715.6 | 87.2 | |
| 1.000 | 1537 | 523.5 | 82.6 |
根据方程式2计算的不同浓度SA在不同温度下的缓蚀效率列于表3。由表可见,在一定温度下,SA的加入将减缓腐蚀过程,并且其作用随温度升高而降低。当温度升高时,分子热运动加速,SA分子在金属表面的吸附/脱附平衡被打破,结果将导致缓蚀率降低。当浓度达到0.5 g L-1时,在298 K时SA的缓蚀效率达到最大94.7%。EIS结果与极化曲线结果一致。此外,从表中还可以看到,即使在高温(328 K)下,其缓蚀效率还保持较高水平,说明该缓蚀剂可在较宽温度范围内使用。
3.3 吸附等温线和热力学参数
通常认为有机缓蚀剂分子在金属溶液界面的吸附是一个取代表面吸附水的过程[11]:
Org(sol) + xH2O(ads) 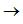 Org(ads) + xH2O(sol)
Org(ads) + xH2O(sol)
其中x为水分子被1摩尔有机分子的取代量。不同浓度SA在3.5% NaCl溶液中Q235钢表面覆盖度(θ)可被用于吸附等温线研究,在这里,θ可被写成[8]:
θ = hE/100(3)
吸附等温线将提供SA分子在碳钢表面的吸附过程信息。在此研究中,我们采用多种模型,包括Frumkin、Temkin、Freundlich和Langmuir对其进行拟合[11, 12]。根据这些吸附等温式,θ与SA浓度关系可表示为:
Frumkin: log(θ/(1-θ)C) = logK + gθ(4)
Temkin: log(θ/C) = logK - gθ(5)
Freundlich: θ = KC(6)
Langmuir: C/θ = 1/K + C(7)
其中K 是吸附/脱附平衡常数。相应的拟合曲线见图5。由图可见,C/θ对C曲线为一直线,线性相关系数为0.9995,表明SA在碳钢表面的吸附符合Langmuir吸附等温线。此外,其他温度得到的数据也符合Langmuir吸附等温线(图6)。
缓蚀剂分子的吸附自由能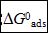 可由吸附/脱附平衡常数计算,而K值可以用下列方程求得[11]:
可由吸附/脱附平衡常数计算,而K值可以用下列方程求得[11]:
 (8)
(8)
其中55.5是溶液中水的摩尔浓度,单位M,R是气体常数,T是热力学温度。不同温度下,通过Langmuir 吸附等温线求得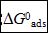 值列于表4。其值为负代表吸附过程为自发过程。通常,该值大于-20 kJ mol-1被认为是物理吸附过程;而小于-40 kJ mol-1被认为是化学吸附过程[11]。在表4中,
值列于表4。其值为负代表吸附过程为自发过程。通常,该值大于-20 kJ mol-1被认为是物理吸附过程;而小于-40 kJ mol-1被认为是化学吸附过程[11]。在表4中,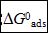 值的范围在-47到-51 kJ mol-1之间,表示SA分子是化学吸附在碳钢表面形成保护膜。从表4中还可以看出K值随温度升高而减小。K值通常表示SA分子的吸附能力,很明显,在低温时K值较大,说明低温时吸附能力更强。因此,温度升高将导致SA脱附,降低缓蚀效率。
值的范围在-47到-51 kJ mol-1之间,表示SA分子是化学吸附在碳钢表面形成保护膜。从表4中还可以看出K值随温度升高而减小。K值通常表示SA分子的吸附能力,很明显,在低温时K值较大,说明低温时吸附能力更强。因此,温度升高将导致SA脱附,降低缓蚀效率。
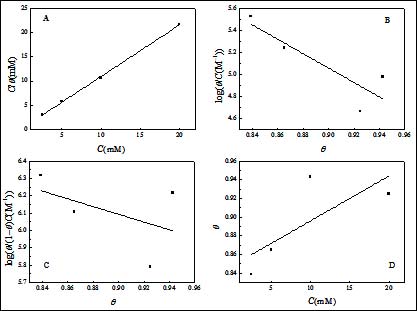
图5. 298 K时SA在3.5% NaCl溶液中吸附等温线(A:Langmuir,B:Temkin,C:Frumkin,D:Freundlich)
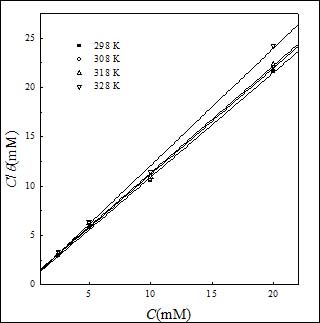
图6. 不同温度下C/θ与C关系曲线
吸附函ΔHads可通过Van't Hoff方程计算[24]:
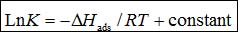 (9)
(9)
图7给出了LnK对1/T关系直线,线性相关系数0.9677.在实验条件下,吸附函可近似认为是标准吸附函(ΔH0ads)[24]。根据热力学基本方程式DG0ads=DH0ads-TDS0ads可求出标准吸附熵ΔS0ads。
所有求出的热力学参数列于表4。ΔH0ads值为负表明吸附过程为放热过程,ΔS0ads值为负可以被解释为SA分子取代水分子的吸附过程被认为是吸热过程,将导致溶液熵减小,其对溶液也是适用的。得到的热力学参数值是SA分子吸附和水分子脱附的加合。因此,熵增被认为是溶液熵增大的结果[25]。#p#分页标题#e#
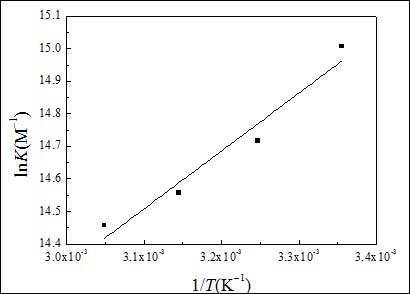
图7. lnK与1/T关系曲线
表4. 根据Langmuir吸附等温线计算的热力学参数
| T | DG0ads | DH0ads | DS0ads |
| (K) | (kJ mol-1) | (kJ mol-1) | (J mol-1 K-1) |
| 298 | -47.13 | -14.80 | 108.49 |
| 308 | -47.97 | -14.80 | 107.69 |
| 318 | -49.11 | -14.80 | 107.89 |
| 328 | -50.40 | -14.80 | 108.54 |
4 结论
通过以上实验结果分析与讨论,可得到如下结论:
(1)SA对于Q235钢在模拟海水(3.5% NaCl溶液)中的腐蚀是一类有效的缓蚀剂,特别是浓度为0.5 g L-1时,298 K时缓蚀率达94.7%。缓释效率随温度升高而降低。
(2)极化曲线测试结果表明SA是一类阳极型缓蚀剂。
(3)EIS研究结果表明缓蚀剂在碳钢表面的吸附增大电荷转移电阻,起到缓蚀作用。极化曲线和EIS结果一致。
(4)SA分子在碳钢表面吸附符合Langmuir吸附等温线。吸附过程是一个自发和放热过程。
References(参考文献)
[1]Morad M. S. Effect of amino acids containing sulfur on the corrosion of mild steel in phosphoric acid solutions containing Cl, F and Fe3+ ions: Behavior under polarization conditions[J]. J. Appl. Electrochem., 2005, 35: 889-895.
[2]Moretti G., Guidi F., and Grion G. Tryptamine as a green iron corrosion inhibitor in 0.5 M deaerated sulphuric acid[J]. Corros. Sci., 2004, 46: 387-403.
[3]Aballe A., Bethencourt M., Botana F. J., et al. CeCl3 and LaCl3 binary solutions as environment-friendly corrosion inhibitors of AA5083 Al-Mg alloy in NaCl solutions[J]. J. Alloys Compd., 2001, 323: 855-858.
[4]Bethencourt M., Botana F. J., Cauqui M. A., et al. Protection against corrosion in marine environments of AA5083 Al-Mg alloy by lanthanide chlorides[J]. J. Alloys Compd., 1997, 250: 455-460.
[5]Bethencourt M., Botana F. J., Calvino J. J., et al. Lanthanide compounds as environmentally-friendly corrosion inhibitors of aluminum alloys: A review[J]. Corros. Sci., 1998, 40: 1803-1819.
[6]Arenas M. A., Bethencourt M., Botana F. J., et al. Inhibition of 5083 aluminum alloy and galvanised steel by lanthanide salts[J]. Corros. Sci., 2001, 43: 157-170.
[7]Giacomelli F. C., Giacomelli C., Amadori M. F., et al. Inhibitor effect of succinic acid on the corrosion resistance of mild steel: electrochemical, gravimetric and optical microscopic studies[J]. Mater. Chem. Phys., 2004, 83: 124-128.
[8]Fu J. J., Li S. N., Cao L. H., et al. l-Tryptophan as green corrosion inhibitor for low carbon steel in hydrochloric acid solution[J]. J. Mater. Sci., 2010, 45: 979-986.
[9]Cui R., Gu N., and Li C. Polyaspartic acid as a green corrosion inhibitor for carbon steel[J]. Mater. Corros., 2010, DOI: 10.1002/maco.200905511.
[10]Ashassi-Sorkhabi H. and Asghari E. Effect of hydrodynamic conditions on the inhibition performance of l-methionine as a “green” inhibitor[J]. Electrochim. Acta, 2008, 54: 162-167.
[11]Obot I. B., Obi-Egbedi N. O., and Umoren S. A. Antifungal drugs as corrosion inhibitors for aluminium in 0.1 M HCl[J]. Corros. Sci., 2009, 51: 1868-1875.
[12]de Souza F. S. and Spinelli A. Caffeic acid as a green corrosion inhibitor for mild steel[J]. Corros. Sci., 2009, 51: 642-649.
[13]Ozcan M., Solmaz R., Kardas G., et al. Adsorption properties of barbiturates as green corrosion inhibitors on mild steel in phosphoric acid[J]. Colloids Surf. A, 2008, 325: 57-63.
[14]Kardas G. and Solmaz R. Electrochemical investigation of barbiturates as green corrosion inhibitors for mild steel protection[J]. Corros. Rev., 2006, 24: 151-171.
[15]Raja P. B. and Sethuraman M. G. -Natural products as corrosion inhibitor for metals in corrosive mediaA review [J]. Mater. Lett., 2008, 62: 113-116.
[16]Quraishi M. A., Singh A., Singh V. K., et al. Green approach to corrosion inhibition of mild steel in hydrochloric acid and sulphuric acid solutions by the extract of Murraya koenigii leaves[J]. Mater. Chem. Phys., 2010, 122: 114-122.
[17]Abiola O. K., Otaigbe J. O. E., and Kio O. J. Gossipium hirsutum L. extracts as green corrosion inhibitor for aluminum in NaOH solution[J]. Corros. Sci., 2009, 51: 1879-1881.
#p#分页标题#e#
[18]Drury J. L. and Mooney D. J. Hydrogels for tissue engineering: scaffold design variables and applications[J]. Biomaterials, 2003, 24: 4337-4351.
[19]Riggs Jr O. L. Corrosion Inhibitors[M]. Houston TX: NACE, 1973.
[20]Aksut A. A., Lorenz W. J., and Mansfeld F. The determination of corrosion rates by electrochemical D.C. and A.C. methods-II. Systems with discontinuous steady state polarization behavior[J]. Corros. Sci., 1982, 22: 611-619.
[21]Kendig M. W., Meyer E. M., Lidberg G., et al. A computer analysis of electrochemical impedance data[J]. Corros. Sci., 1983, 23: 1007-1015.
[22]De Levie R. The influence of surface roughness of solid electrodes on electrochemical measurements[J]. Electrochim. Acta, 1965, 10: 113-110.
[23]Salasi M., Shahrabi T., Roayaei E., et al. The electrochemical behaviour of environment-friendly inhibitors of silicate and phosphonate in corrosion control of carbon steel in soft water media[J]. Mater. Chem. Phys., 2007, 104: 183-190.
[24]Tang L., Mu G., and Liu G. The effect of neutral red on the corrosion inhibition of cold rolled steel in 1.0 M hydrochloric acid[J]. Corros. Sci., 2003, 45: 2251-2262.
[25]Ateya B. G., El-Anadouli B. E., and El-Nizamy F. M. The adsorption of thiourea on mild steel[J]. Corros. Sci., 1984, 24: 509-515.





















